dr inż. Katarzyna Tkacz
dr hab. inż. Monika Modzelewska-Kapituła, prof. UWM
mgr inż. Anna Maja Osewska
mgr inż. Weronika Zduńczyk
Katedra Technologii i Chemii Mięsa
Wydział Nauki o Żywności
Uniwersytet Warmińsko-Mazurski w Olsztynie
Dla konsumentów jednym z najważniejszych parametrów jakości mięsa, na podstawie którego decydują oni o zakupie, jest jego barwa. Chociaż barwa mięsa nie jest wiarygodnym prognostykiem jego bezpieczeństwa i jakości, to w ocenie konsumenckiej jest to wskaźnik, na podstawie którego mogą oni przewidzieć jakość potrawy, którą z niego przygotują. Dlatego barwa – umiejętność jej pomiaru i prawidłowej interpretacji – jest tak ważna dla producentów i sprzedawców mięsa, gdyż warunkuje ona wielkość sprzedaży mięsa świeżego, która przekłada się na opłacalność przedsiębiorstwa.

Na barwę mięsa wpływa wiele czynników, które można podzielić na przyżyciowe i poubojowe. Wśród przyżyciowych duże znaczenie odgrywają czynniki genetyczne takie jak rasa, wiek, płeć oraz pozagenetyczne: system żywieniowy, postępowanie ze zwierzętami przed ubojem oraz z tuszami po uboju. Oprócz wymienionych na barwę duży wpływ wywierają naturalne różnice między mięśniami, spowodowane różną budową i funkcją fizjologiczną (Domaradzki i in. 2016, Tkacz i in. 2020). Najważniejsze poubojowe czynniki to postępowanie z tuszami oraz z mięsem po uboju, czyli wychładzanie i rozbiór tusz oraz dojrzewanie i pakowanie. Podstawą do uzyskania mięsa o atrakcyjnej, pożądanej przez konsumentów barwie jest stworzenie prawidłowych warunków podczas przemian po uboju w tkance mięśniowej (Modzelewska-Kapituła i in. 2019, Piaskowska i in. 2015).
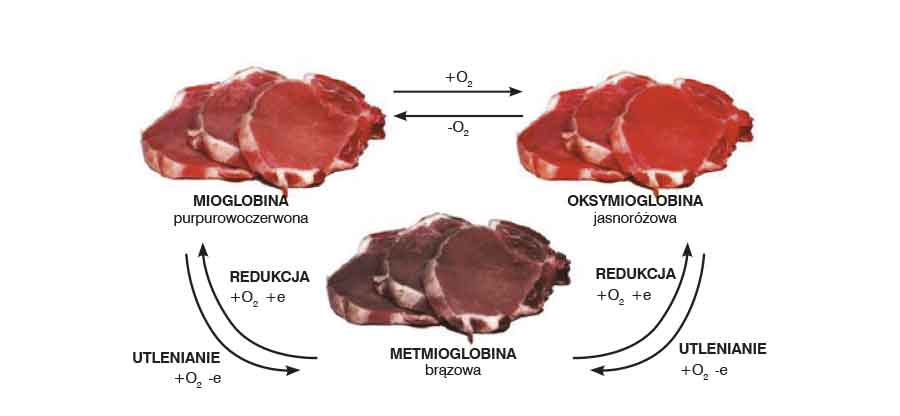
Barwę mięsa zasadniczo kształtuje stężenie i forma chemiczna zawartego w nim barwnika hemowego, jakim jest mioglobina. Pozostałe hemoproteidy – hemoglobina i cytochrom „c” w niewielkim stopniu decydują o barwie mięsa. Mioglobina stanowi ok. 90% wszystkich barwników mięsa i w zależności od obecności ligandu połączonego z atomem żelaza hemu, a także od wartościowości żelaza w świeżym mięsie, występuje w trzech formach: dezoksymioglobina (barwa purpurowo-czerwona), oksymioglobina (barwa różowoczerwona) i metmioglobina (barwa szarobrunatna) – Rys. 1.
Rysunek 1. Przemiany mioglobiny w mięsie Źródło: https://www.spozywczetechnologie.pl/miesne-technologie/higiena/396/innowacja-w-higienie-wykorzystanie-preparatu-hysepta-m1-fg-w-stabilizacji-mikrobiologicznej-miesa
Barwnik w postaci dezoksymioglobiny pozostaje niezmieniony jedynie przy niskim ciśnieniu parcjalnym tlenu (<1,4 mm Hg) oraz gdy żelazo hemu występuję w postaci Fe2+ (Wyrwisz i in. 2016, Kołczak 2007).
Poziom mioglobiny m.in. warunkowany jest aktywnością fizjologiczną mięśnia. Takie same anatomiczne mięśnie różnych gatunków zwierząt, jak i inne mięśnie tej samej tuszy, wyróżniają się zmienną aktywnością enzymów oddechowych, dlatego też barwa na powierzchni tkanki mięśniowej, jak i warstw podpowierzchniowych, jest zmienna podczas dojrzewania mięsa. W świeżym mięsie usytuowanie form mioglobiny jest następujące (Karamucki 2016, Kołczak 2007): w warstwie, do której nie dociera tlen, występuje dezoksymioglobina, dookoła niej dominuje metmioglobina, a nad nią – ze względu na obecność tlenu – oksymioglobina – Rys. 2.
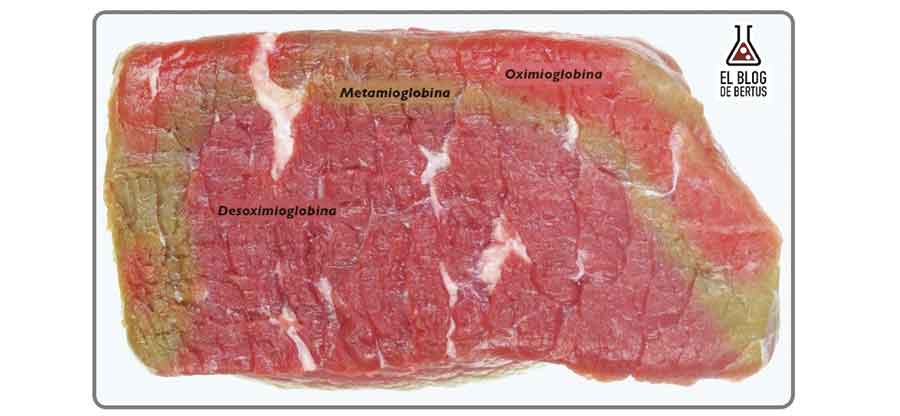 Rysunek 2. Formy chemiczne mioglobiny występujące w mięsie. Źródło: http://notinerd.com/galeria-16-curiosidades-de-la-quimica-que-vives-dia-a-dia/
Rysunek 2. Formy chemiczne mioglobiny występujące w mięsie. Źródło: http://notinerd.com/galeria-16-curiosidades-de-la-quimica-que-vives-dia-a-dia/
Wartości parametrów barwy mierzonych w świeżym mięsie zależą również od składu chemicznego mięsa, jego struktury (wielkości przestrzeni międzykomórkowych, stopnia denaturacji białek w mięśniach), a także tempa i zasięgu obniżania się pH podczas procesu dojrzewania. Czynniki te determinują stopień wnikania światła i tlenu w tkankę mięśniową, co ma wpływ na formę mioglobiny i w efekcie kształtuje barwę mięsa. Mięśnie po uboju charakteryzują się intensywną czerwoną i błyszczącą barwą, elastycznością oraz miękkością. Wartości pH bezpośrednio po uboju kształtują się na poziomie 6,8-7, a po ok. 36 h wartość ta wynosi ok. 5,7-6,0. Obniżenie pH mięsa, a także zmniejszenie siły wiązania wody, wpływa na zmianę barwy. Stężenie poubojowe powoduje, że mięśnie matowieją, tracą elastyczność i twardnieją (Onopiuk i in. 2016, Wyrwisz i in. 2012).
Trwałość barwy mięsa w czasie przechowywania i dystrybucji w znaczącym stopniu kształtowana jest przez ciśnienie tlenu, temperaturę, wilgotność, światło, czynniki mikrobiologiczne oraz zdolność mięsa do redukcji metmioglobiny, a także dostępności tlenu w mięśniach, na którą wpływa aktywność enzymów cyklu oddechowego (Bocian i in. 2015, Karamucki 2016, Mancini i in. 2014). W okresie poubojowym za stabilizację barwy mięsa w znaczącym stopniu odpowiedzialna jest aktywność reduktazy metmioglobiny, na którą wpływa m.in.:
• rodzaj mięśnia i gatunek zwierzęcia – wyższa aktywność reduktazy metmioglobiny obserwowana jest w przypadku mięśni zwierząt, które cechowały się zwiększoną aktywnością fizyczną;
• proces utleniania lipidów – podczas utleniania lipidów aktywność reduktazy metmioglobiny maleje; duża zawartość przeciwutleniaczy zwiększa aktywność reduktazy;
• światło – aktywność redukująca jest większa w ciemności niż w przypadku mięsa przechowywanego z zastosowaniem jasnego oświetlenia;
• temperatura – w zakresie 30-37oC aktywność reduktazy metmioglobiny jest najwyższa;
• czas przechowywania – im dłuższy czas przechowywania, tym mniejsza aktywność redukująca (Kołczak 2008).
Barwę mięsa, jak też innych produktów, można ocenić wzrokowo, co pozwala na określenie wstępnej jakości produktu, gdyż oko ludzkie potrafi zauważyć nawet niewielkie odchylenia w barwie. Metoda ta ułatwia podjęcie przez konsumenta decyzji o zakupie, jednak jest to ocena subiektywna, na którą wpływa wiele czynników (np. rodzaj oświetlenia, upodobania konsumenta oraz jego stan psychofizyczny, budowa oka). Pomiar barwy dokonywany jest również z zastosowaniem analizy sensorycznej, jednak mimo zastosowania odpowiednich metod oceny poprzez przeszkolony zespół oceniający, jest to także metoda subiektywna.
Europejska Komisja Gospodarcza w Standardach EKG/ONZ (UNECE) (2014) dotyczących mięsa wołowego podaje referencyjne barwy mięsa – Rys 3.
 Rysunek 3. Zakres barw wzorców dla mięsa wołowego. Źródło: https://www.bazawiedzywolowina.pl/rgdu-barwa-miesa
Rysunek 3. Zakres barw wzorców dla mięsa wołowego. Źródło: https://www.bazawiedzywolowina.pl/rgdu-barwa-miesa
Barwę wołowiny według tego wzorca ocenia się na powierzchni oka mięśnia longissimus thoracis et lumborum od strony antrykotu po rozcięciu i ekspozycji na działanie światła (ok. 1 min) na schłodzonej tuszy – Rys. 4.
Rysunek 4. Miejsce pomiaru barwy mięśnia longissimus thoracis et lumborum w tuszy. Źródło: https://www.bazawiedzywolowina.pl/rgdu-barwa-miesa
Prawidłowe określenie barwy mięsa jest bardzo istotne zarówno dla zakładów przemysłu mięsnego, jak i w badaniach naukowych. Na podstawie barwy dokonuje się m.in. klasyfikacji oraz oceny jakości surowca (Chmiel i in. 2016). Obiektywne wyniki wyróżnika, jakim jest barwa, można uzyskać metodami instrumentalnymi poprzez zastosowanie kolorymetrów, spektrofotometrów, czy też komputerowej analizy obrazu. W pomiarach instrumentalnych wykorzystuje się różnego rodzaju modele matematyczne, które opisują barwę w postaci punktów o trzech współrzędnych. Do badania percepcji kolorów został opracowany matematyczny model CIE Lab stworzony przez Międzynarodową Komisję Oświetleniową (CIE – fr. Comission Internationale de l’Eclairage; 1978). Barwę opisują matematycznie trzy składowe: parametr L* określa jasność, współrzędne a* i b* mogą przyjmować wartości dodatnie i ujemne. Dodatnie wartości współrzędnej a* określają udział barwy czerwonej, natomiast ujemne – zielonej, dodatnie wartości współrzędnej b* odnoszą się do udziału barwy żółtej, a ujemne – niebieskiej.
Jest to najpopularniejszy sposób opisu barwy i jest podstawą wszystkich systemów diagnostyki barw, który pozwala na uniezależnienie identyfikacji od klasy przyrządu (Molenda i in. 2012, Wulf i in. 1999). Przy instrumentalnej kolorymetrycznej ocenie barwy mięsa należy zapewnić właściwe warunki pomiaru związane ze źródłem światła i rodzajem użytego obserwatora kolorymetrycznego. Pierwsze przenośne maszyny zostały opracowane przez Minolta i umożliwiły łatwe pomiary barwy na powierzchni mięsa. Zdobyły dużą popularność ze względu na swój mały rozmiar, przystępną cenę i łatwość obsługi. Najczęściej stosowanymi aparatami do pomiaru barwy są kolorymetry, które pozwalają uzyskać precyzyjne i powtarzalne wyniki. Wadą tych aparatów jest ograniczona powierzchnia mięsa przy pomiarze, która uzależniona jest od wielkości otworu pomiarowego. Jest to szczególnie uciążliwe w przypadku niejednorodnego produktu (Karamucki 2016, Dobrzańska i in. 2014, Kołczak 2007, Zapotoczny i in. 2005). Warunkiem ujednolicenia sposobu oceny barwy mięsa jest sposób przygotowania próbek do badań i prawidłowe ich opisanie. Opis badanych próbek powinien uwzględniać informacje na temat rasy i gatunku zwierzęcia, sposobu żywienia i chowu, jego wieku oraz sposób transportu i warunki uboju. Próby mięśnia należy ciąć w poprzek włókien mięśniowych i zachować minimalną grubość 1,5 cm. Próbki do badań prawidłowo pobiera się 24h po uboju, a podczas dłuższego przechowywania temperatura nie powinna być wyższa niż +3°C. Wpływ na wynik pomiaru ma również czas upływający od chwili przygotowania próbki mięsa do wykonania pomiaru. Na powierzchni mięsa po przecięciu dochodzi do utlenowania mioglobiny do oksymioglobiny i jest to tzw. kwitnienie (blooming). Pomiar barwy mięśnia dokonuje się w powtórzeniach (od 3 do 5) w różnych miejscach, co pozwala na uzyskanie dokładnych i miarodajnych wyników (Molenda i in. 2012).
Na wynik pomiaru barwy mięsa wpływa rodzaj oświetlenia i natężenie światła. Dlatego do pomiaru barwy mięsa najczęściej stosuje się iluminaty światła dziennego – C i D65 (Karamucki 2016). Handlowcy, aby zachęcić konsumentów do zakupu, stosują specjalne oświetlenie mające na celu stworzenie wrażenia o świeżości i atrakcyjności produktu. W przypadku mięsa stosuje się światło silniejsze w czerwonym odcinku spektrum, co optycznie wzmacnia jego czerwoną barwę, natomiast nie zaleca się stosowania światła niebieskiego lub zielonego. Barwa jest niezwykle ważnym wyróżnikiem jakości mięsa i jest kształtowana na każdym etapie jego produkcji oraz dystrybucji. Należy więc dołożyć wszelkich starań, aby jak najdłużej zachować jaskrawoczerwoną, intensywną barwę mięsa, będącą atrakcyjną dla konsumenta, poprzez staranny dobór metody pakowania oraz oświetlenia mięsa podczas jego ekspozycji w handlu.
WYKAZ PIŚMIENNICTWA:
1. Bocian M., Jankowiak H., Kapelański W., 2015, Zmiany barwy mięsa w trakcie przechowywania. Nauka Przyr. Technol., 9, 4, 1-6.
2. Borowy T., 2014, Barwa mięsa i przetworów mięsnych, możliwość i ograniczenia zachowania wysokiej jakości konsumenckiej. Informator masarski, 9, 60-68.
3. Chmiel M., Słowiński M, 2016, Kształtowanie się barwy mięsa wołowego podczas trwania procesu „blooming”. Żywność. Nauka. Technologia. Jakość, 6 (109), 102-112.
4. Commission Internationale De L’Eclairage (CIE) 1978, Recommendations on uniform color spacer, color difference equations, psychimetric color terms. Supplement No. 2 to CIE Publication No. 15 (E-1.3.1.) 1971/(TC-1-1), Bureau Central de la CIE, Paris, 1978.
5. Dobrzańska A., Cais-Sokolińska D., 2014, Ocena przydatności systemów pomiaru barwy do badań preparatów białek mleka i serwatki. Aparatura badawcza i dydaktyczna, 3, 267-272.
6. Domaradzki P., Litwińczuk Z., Florek M., Litwińczuk A., 2016, Zmiany właściwości fizykochemicznych i sensorycznych mięsa wołowego w zależności od warunków jego dojrzewania. Żywność. Nauka. Technologia. Jakość, 3 (106), 35-53.
7. Karamucki T., 2016, Barwa mięsa surowego. Gospodarka Mięsna, 10, 28-31.
8. Kołczak T., 2007, Barwa mięsa. Gospodarka Mięsna, 09, 12-16.
9. Mancini R.A., Ramanathan R., 2014, Effects of postmortem storage time on color and mitochondria in beef. Meat Science, 98, 65-70.
10. Modzelewska-Kapituła M., Tkacz K., Nogalski Z., Karpińska-Tymoszczyk M., Więk A., 2019. Influence of ageing on longissimus lumborum quality from Holstein-Friesian young bulls fed different diets. Journal of Food Science and Technology, 56(7):3215–3224. doi: 10.1007/s13197-019-03778-7
11. Molenda J., Wrona M., Siwiec W., 2012, Zastosowanie Modelu CIE Lab w badaniach barwy lotnych popiołów. Problemy eksploatacji, nr 3, 177-187.
12. Onopiuk A., Półtorak A., Wierzbicka A., 2016, Influence of post-mortem muscle glycogen content on the quality of beef during aging. J Vet Res 60, 301-307.
13. Piaskowska N. Śmiecińska K., 2015, Dojrzewanie poubojowe a jakość wołowiny. Gospodarka Mięsna, 08, 34-36.
14. Tkacz K., Modzelewska-Kapituła M., Więk A., Nogalski Z., 2020, The applicability of total color difference E for determining the blooming time in longissimus lumborum and semimembranosus muscles from Holstein-Friesian bulls at different ageing times. Applied Sciences, 10, 8215; doi:10.3390/app10228215
15. Wulf D.M., Wise J.W., 1999, Measuring muscle color on beef carcasses using the L*a*b* color space. J. Anim. Sci., 77, 2418-2427.
16. Wywrisz J., Półtorak A., Zalewska M., Zaremba R., Wierzbicka A., 2012, Analysis of relationship between basic composition, pH, and physical properties of selected bovine muscls. Bull Vet Inst Pulawy, 56, 403-409.
17. Zapotoczny P., Zielińska M., 2005, Rozważania nad metodyką instrumentalnego pomiaru barwy marchwi. Żywność. Nauka. Technologia. Jakość, 1(42), 121-132.